M.D.
numero 4, 14 febbraio 2007
Rassegna
Calcitriolo e osteoporosi
di Ranuccio Nuti, Giuseppe Martini, Luigi Gennari, Fabrizio
Valleggi, Daniela Merlotti, Dipartimento di Medicina Interna,
Scienze Endocrino-Metaboliche e Biochimica - Università
degli Studi di Siena
Il calcitriolo rappresenta una valida alternativa per il
trattamento dell’osteoporosi e delle sue forme secondarie,
nonché per la riduzione delle fratture
I
due nutrienti più importanti per la salute
dell’osso sono il calcio e la vitamina D. La ridotta assunzione
di calcio può essere associata ad una ridotta massa ossea
e ad osteoporosi, mentre una grave e cronica deficienza di vitamina
D determina osteomalacia, una malattia metabolica dell’osso
caratterizzata da una diminuita mineralizzazione della matrice
ossea e da aumentato tessuto osteoide.
La più importante fonte di vitamina D è la pelle,
dove viene prodotta grazie all’azione della luce ultravioletta
sui precursori steroidei. La vitamina D è anche presente
in alcuni alimenti sia vegetali (vitamina D2 o ergocalciferolo)
sia animali (vitamina D3 o colecalciferolo), quali il pesce
(salmone, sardine, tonno), la carne (fegato), uova e funghi
selvatici. Viene trasportata al fegato legata a una specifica
a-globulina (vitamina D binding protein) e in piccola parte
ad albumina e lipoproteine; nel fegato viene metabolizzata a
25(OH)D, che rappresenta la più importante forma di deposito
in quanto ha una lunga emivita.
Nel rene la 25(OH)D viene ulteriormente metabolizzata dall’enzima
1a-idrossilasi ad 1,25(OH2)D o calcitriolo, l’ormone responsabile
degli effetti biologici. Il legame del calcitriolo al recettore
della vitamina D (VDR), un recettore nucleare per gli ormoni
steroidei, attiva VDR stesso che interagisce con il recettore
retinoideo X (RXR) e forma il complesso VDR-RXR-cofattore, che
si lega agli “vitamin D response elements” nella regione
promoter di geni bersaglio al fine di regolare la trascrizione
dei geni stessi.
Il calcitriolo è il più importante metabolita
biologicamente attivo della vitamina D, e i principali regolatori
della sua produzione sono l’ormone paratiroideo (PTH),
la 1,25(OH)2D stessa, e l’apporto dietetico di calcio e
fosfato. Gli organi bersaglio per la 1,25(OH)2D circolante sono
essenzialmente tre: l’intestino, le ghiandole paratiroidi
e l’osso. Gli effetti della 1,25(OH)2D sul metabolismo
minerale sono caratterizzati da:
1. aumentato assorbimento intestinale di calcio che determina
un incremento del calcio sierico;
2. diminuzione dei livelli circolanti di PTH sia attraverso
l’inibizione diretta della secrezione di PTH dalle ghiandole
paratiroidi sia in modo indiretto per l’aumento dei livelli
sierici di calcio;
3. diminuito riassorbimento osseo (principalmente dovuto ad
una riduzione del riassorbimento osseo PTH-mediato);
4. aumentata formazione ossea.1
Quando lo stato vitaminico D è nella norma, il piccolo
intestino assorbe circa il 30% del calcio alimentare. In caso
di insufficienza vitaminica l’assorbimento intestinale
del calcio si svolge principalmente attraverso un percorso extracellulare,
passivo, che limita l’assorbimento complessivo del calcio
a circa il 10-15% dell’apporto dietetico.
La sintesi cutanea di provitamina D è massima in estate
e minima in inverno, ed esiste una associazione inversa tra
basse concentrazioni di 25(OH)D e latitudine. Quando i valori
circolanti di 25(OH)D cadono al di sotto di 30 ng/ml si ha un
aumento della secrezione di PTH2 con aumento del riassorbimento
osseo che se dura nel tempo può risultare in osteopenia.
La patogenesi della perdita ossea correlata all’età
è in parte dovuta a un ridotto assorbimento di calcio
da parte dell’intestino dovuto all’invecchiamento
e a una diminuita sintesi di 1,25(OH)2D da parte del rene per
una perdita, sempre correlata all’età, della capacità
dell’1a-idrossilasi renale di rispondere al progressivo
innalzamento del PTH.3
Inoltre il tempo di esposizione solare generalmente si riduce
con l’età e la sintesi endogena di vitamina D diminuisce
nelle persone anziane anche a causa dei cambiamenti trofici
dell’epidermide.4-5 È stato dimostrato come le donne
osteoporotiche siano caratterizzate da un ridotto assorbimento
di calcio quando confrontate con controlli della stessa età.6
La deficienza di vitamina D può essere confermata attraverso
la misurazione sierica di 25-idrossivitamina D (25(OH)D). Nei
pazienti con osteomalacia i livelli sierici di 25(OH)D sono
solitamente al di sotto dei 5-6 ng/ml e spesso indosabili. Le
principali cause di deficienza di vitamina D sono: una scarsa
esposizione alla luce solare, una diminuzione della sintesi
cutanea di vitamina D, una dieta carente e una diminuita idrossilazione
renale. La deficienza subclinica, caratterizzata da livelli
circolanti di 25(OH)D compresi tra 6 e 30 ng/ml viene definita
come insufficienza. L’insufficienza di vitamina D, in seguito
all’aumento della secrezione di PTH necessario per mantenere
adeguati livelli plasmatici di calcio, può determinare
un incremento della perdita ossea e quindi del rischio di frattura.
Ne consegue che negli anziani è necessario un adeguato
apporto sia di calcio e soprattutto di vitamina D al fine di
preservare la massa ossea e prevenire l’osteoporosi.7,8
Evidenze dalla letteratura su calcitriolo e osteoporosi
Le forme di vitamina D 1a-idrossilate, l’1,25-diidrossicolecalciferolo
o calcitriolo, e l’1a-idrossicalciferolo o alfacalcidolo,
rappresentano valide alternative per la prevenzione dell’osteoporosi.9
Entrambi i composti stimolano infatti l’assorbimento intestinale
del calcio e la risposta è dose dipendente. Essi determinano
anche una soppressione della secrezione del PTH.
A livello osseo, il calcitriolo determina una diminuizione del
riassorbimento osseo con effetti stimolanti sulla neoformazione
ossea. A tale riguardo, un recente studio eseguito in vitro
ha suggerito che il calcitriolo potrebbe incrementare la sensibilità
degli osteoblasti agli stimoli degli ormoni gonadici (17beta-estradiolo
e diidrotestosterone) e anche al raloxifene.10
Inoltre, gli incrementi dei livelli sierici di osteocalcina
osservati negli uomini trattati con 1,25(OH)2D e gli studi su
animali che dimostrano un aumentato numero di precursori degli
osteoblasti nel midollo osseo durante la somministrazione di
1,25(OH)2D confermano l’ipotesi secondo cui le anormalità
nella produzione e nella distribuzione scheletrica di 1,25(OH)2D
possono contribuire alla diminuita funzione degli osteoblasti
e alla diminuita formazione ossea.11
In donne con recente frattura del femore si hanno livelli ossei
di 1,25(OH)2D marcatamente ridotti, così come ridotti
sono i livelli circolanti di 25(OH)D, facendo quindi presupporre
un effetto diretto della vitamina D sulla qualità dell’osso.12
A tale proposito, sono stati valutati gli effetti del calcitriolo
sul topo SAM-P/6, un modello di osteoporosi senile ormono-indipendente
caratterizzato da ridotta formazione ossea. La densità
minerale ossea incrementava rapidamente di circa il 30% nei
topi trattati, mentre si riduceva in modo significativo nei
controlli. L’istomorfometria eseguita sui topi trattati
ha dimostrato che il calcitriolo è in grado di aumentare
il volume osseo e altri parametri della qualità dell’osso,
come la velocità di formazione dell’osso subperiostale,
mentre non ha dimostrato effetti significativi sull’osso
trabecolare. Il trattamento con calcitriolo riduce anche il
numero degli osteoclasti a livello della lacuna di erosione.13
Sono stati condotti numerosi trial clinici su pazienti osteoporotici
usando calcitriolo o altri metabolici idrossilati della vitamina
D quali l’alfacalcidolo alle dosi comprese tra 0.25 e
2 µg/die. Tali composti hanno dimostrato complessivamente
di avere un effetto positivo sulla massa ossea. Una metanalisi
ha mostrato un consistente effetto, statisticamente significativo,
della vitamina D idrossilata sulla BMD con dosi al di sopra
di 0.43 µg/die, con effetto complessivo migliore rispetto
al trattamento standard con vitamina D.14
Più recentemente è stato dimostrato un effetto
globale sulla prevenzione della perdita di massa ossea in pazienti
in terapia con corticosteroidi con una riduzione significativa
dell’incidenza delle fratture, sia di quella vertebrali
sia non vertebrali.15 Gli effetti terapeutici
sembrano essere di tipo farmacologico, piuttosto che fisiologico,
e quindi indipendenti dallo stato vitaminico D. I potenziali
effetti collaterali di questi trattamenti, quali l’ipercalcemia
e il deterioramento della funzionalità renale, sono rari
a basse dosi (fino a 0.5 µg/die) ma più frequenti
ad alte dosi (1-2 µg/die). Per questo motivo il trattamento
con calcitriolo richiede il monitoraggio delle concentrazioni
sieriche di calcio e della funzionalità renale diversamente
da quanto richiesto con la terapia con vitamina D.
È comunque da sottolineare come i trial clinici condotti
negli anni passati allo scopo di valutare l’efficacia del
calcitriolo nell’osteoporosi post-menopausale e senile
hanno fornito risultati contrastanti sia per le differenze nel
disegno degli studi che per il dosaggio di farmaco usato.16-21
Da alcuni studi emerge che la finestra terapeutica del calcitriolo
è abbastanza ristretta: mentre 0.4 µg/die sono
sufficienti per aumentare l’assorbimento di calcio in molti
pazienti, una dose di 0.5 µg/die o maggiore è efficace
in quasi tutti i pazienti con appropriato apporto dietetico
di calcio.9,22,23 Non dovrebbe però
essere superata la dose di 0.8 µg/die per non incorrere
nel rischio di ipercalcemia. Alla dose compresa tra 0.5 e 0.8
µg/die il calcitriolo si è dimostrato capace
di incrementare la BMD in vari distretti scheletrici (total
body e rachide lombare).
 Per
quanto concerne la capacità antifratturativa, una metanalisi
di tutti i principali studi condotti ha evidenziato come il
calcitriolo sia in grado di ridurre in misura significativa
soprattutto le fratture, in particolare quelle vertebrali (figura
1),16 mentre altri studi hanno mostrato
una tendenza positiva, ma non del tutto significativa per le
fratture non vertebrali.17 E ancora, in
uno studio controllato, utilizzando dosi di 0.5 µg di
calcitriolo al giorno è stato possibile dimostrare che
l’incidenza di fratture vertebrali si riduceva in donne
con osteoporosi post-menopausale con meno di 5 fratture vertebrali,
ma non in quelle con più di 5 vertebre fratturate.16
Per
quanto concerne la capacità antifratturativa, una metanalisi
di tutti i principali studi condotti ha evidenziato come il
calcitriolo sia in grado di ridurre in misura significativa
soprattutto le fratture, in particolare quelle vertebrali (figura
1),16 mentre altri studi hanno mostrato
una tendenza positiva, ma non del tutto significativa per le
fratture non vertebrali.17 E ancora, in
uno studio controllato, utilizzando dosi di 0.5 µg di
calcitriolo al giorno è stato possibile dimostrare che
l’incidenza di fratture vertebrali si riduceva in donne
con osteoporosi post-menopausale con meno di 5 fratture vertebrali,
ma non in quelle con più di 5 vertebre fratturate.16
Un più recente trial clinico randomizzato ha infine investigato
gli effetti della terapia con calcitriolo ed estrogeni sulla
BMD, sull’incidenza di cadute e sul rischio di frattura.24
Nei tre anni di trattamento è stata dimostrata una ridotta
incidenza di cadute e fratture vertebrali sia nel gruppo trattato
con solo calcitriolo sia nel gruppo trattato con estrogeni più
calcitriolo, rispetto al placebo. Fra gli altri parametri il
trattamento con calcitriolo ha anche determinato una riduzione
del tempo impiegato per alzarsi da una sedia e una riduzione
del tempo di cammino (figura 2).

Calcitriolo e osteoporosi secondarie
La terapia con calcitriolo si è dimostrata efficace anche
nelle forme secondarie di osteoporosi, sia nell’osteoporosi
da glucocorticoidi sia nella perdita ossea conseguente a trapianto
di cuore, polmoni e fegato.15,25-30
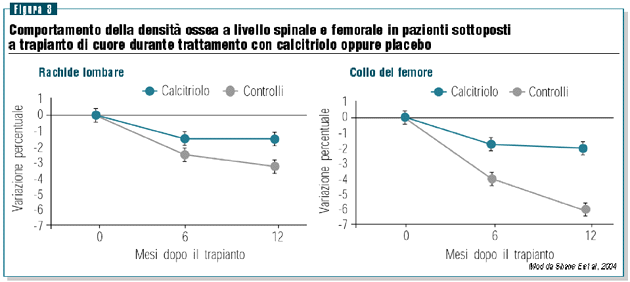
In uno studio condotto su pazienti sottoposti a trapianto di
cuore, la somministrazione di calcitriolo alla dose di 0.5 µg/die
per 12 mesi si è rivelata in grado di minimizzare la
perdita ossea a livello della spina lombare e del femore,
con una differenza comunque statisticamente significativa rispetto
al gruppo placebo, nel quale al termine del follow-up è
stata rilevata una riduzione della massa ossea di circa il 3-6%
(figura 3).26
Il meccanismo d’azione del calcitriolo potrebbe essere
correlato alla correzione dell’iperparatiroidismo secondario
e alle sue proprietà immunomodulanti.16
Calcitriolo in associazione con altri farmaci antiosteoporotici
 Un
importante ruolo per il calcitriolo è stato proposto
anche come terapia aggiuntiva ai bisfosfonati e agli estrogeni
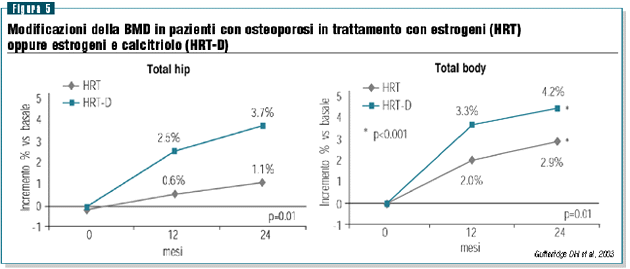
nel trattamento dell’osteoporosi senile. In uno studio
condotto in donne osteoporotiche trattate con la sola terapia
estrogenica oppure con l’associazione estrogeni-calcitriolo
è stato dimostrato come l’azione degli estrogeni
sulla densità ossea delle donne osteoporotiche possa
essere significativamente implementata con l’impiego di
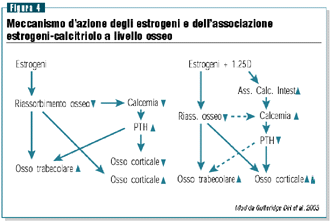
calcitriolo (figura 4). Sotto il profilo fisiopatologico questo
effetto può essere giustificato dal fatto che il calcitriolo
migliorando l‘assorbimento intestinale del calcio è
in grado di ridurre ancora una volta la secrezione paratiroidea
e quindi di incrementare l’osso corticale (figura 5).31,32
Un
importante ruolo per il calcitriolo è stato proposto
anche come terapia aggiuntiva ai bisfosfonati e agli estrogeni
nel trattamento dell’osteoporosi senile. In uno studio
condotto in donne osteoporotiche trattate con la sola terapia
estrogenica oppure con l’associazione estrogeni-calcitriolo
è stato dimostrato come l’azione degli estrogeni
sulla densità ossea delle donne osteoporotiche possa
essere significativamente implementata con l’impiego di
calcitriolo (figura 4). Sotto il profilo fisiopatologico questo
effetto può essere giustificato dal fatto che il calcitriolo
migliorando l‘assorbimento intestinale del calcio è
in grado di ridurre ancora una volta la secrezione paratiroidea
e quindi di incrementare l’osso corticale (figura 5).31,32
Il calcitriolo esercita anche molteplici effetti pleiotropici,
tra i quali quello sulla forza muscolare e sulla coordinazione
neuromuscolare potrebbe risultare importante nella riduzione
del rischio di frattura, in associazione all’effetto sulla
massa ossea.33,34
Altri effetti positivi del calcitriolo sono legati alla prevenzione
e al trattamento di patologie diverse quali la psoriasi e alcune
malattie autoimmuni come la sclerosi multipla. Infine è
da ricordare come il calcitriolo sia stato inserito in protocolli
terapeutici per la cura di alcune neoplasie.
Bibliografia
1. Reichel H et al. N Engl J Med 1989; 320: 980-91.
2. Chapuy MC et al. Osteoporosis Int 1997; 7: 439-43.
3. Gallagher JC J Clin Invest 1979; 64: 729-36.
4. Sahota O Clin Endocrinol 1999; 51: 217-21.
5. Mosekilde L. Clin Endocrinol 2005; 62: 265-81.
6. Holick MF et al. Lancet 1989; 4: 1104-5.
7. Caniggia A et al. Acta Med Scand 1963; 173: 613-17.
8. Gennari C. Public Health Nutr 2001;4:547-59.
9. Nuti R et al. Calcif Tissue Int 2000; 66: 239-40.
10. Katzburg S. J Steroid Biochem Mol Biol 2004; 88: 213-9.
11. De Luca HF. Osteoporos Int 1997; 7: S24-9.
12. Nuti R et al. Clin Orthop 2004; 422: 208-13.
13. Duque G et al. Am J Physiol Endocrinol Metab 2005; 288:
E723-30
14. Richy F et al. Calcif Tissue Int 2005; 76:176-86.
15. Richy F et al. Osteoporos Int 2004; 15: 301-10.
16. Tilyard MW et al. N Engl J Med 1992; 326: 357-62.
17. Gallagher JC et al. Ann Intern Med 1990; 113: 649-55.
18. Ebeling PR et al. J Clin Endocrinol Metab 2001; 86: 4098-4103.
19. Gallagher JC. Metabolism 1990; 39: 27-29.
20. Gallagher JC et al. Proc Soc Exp Biol Med 1989; 191: 287-92.
21. Caniggia A et al. Metabolism 1990; 39: 43-49.
22. Burckhardt P et al. Osteoporos Int 1998; 8: S40-S44.
23. Avioli LV. Calcif Tissue Int 1999; 65: 292-94.
24. Gallagher JC. J Steroid Biochem Mol Biol 2004; 89-90: 497-501.
25. Sambrook PN et al. J Bone Miner Res 2003; 8: 919-24.
26. Shane E et al. N Engl J Med 2004; 350: 767-76.
27. Sambrook PN. J Rheumatol 2005; 76: 41-43.
28. Sambrook P et al. J Bone Miner Res 2000; 15: 1818-24.
29. Josephson MA et al. Transplantation 2004; 78: 1233-36.
30. Torres A et al. Kidney Int 2004; 65: 705-12.
31. Gallagher JC et al. J Clin Endocrinol Metab 2001; 86:
3618-28.
32. Gutteridge DH et al. Calcif Tissue Int 2003; 73: 33-43.
33. Venning G. BMJ 2005; 330: 524-26.
34. Pfeifer M et al. Osteoporos Int 2002; 13: 187-94.
35. Pelezynska K. Postepy Hig Med Dosw 2005; 6: 59: 129-39.