M.D.
numero 36, 30 novembre 2005
Terapia
Le basi della nuova indicazione di candesartan
nello scompenso cardiaco
di Andrea Di Lenarda, Laura Massa, Marco Merlo, Alberto
Pivetta, Daniela Chicco, Gianfranco Sinagra, Dipartimento Cardiovascolare,
Azienda Ospedaliero-Universitaria "Ospedali Riuniti"
e UniversitÓ di Trieste
Dal primo di settembre è stata concessa per candesartan
cilexetil l’indicazione per il trattamento dello scompenso
cardiaco cronico, sulla base dei convincenti risultati provenienti
dallo studio CHARM. Sono attualmente solo due in Italia i sartani
con questa indicazione
Le
linee guida della Società Europea di Cardiologia di recente
pubblicate sull’European Heart Journal (2005; 26: 1115-40)
forniscono chiare indicazioni in merito all’uso degli inibitori
recettoriali dell’angiotensina II (ARBs) nello scompenso
cardiaco (SC), in seguito alla pubblicazione dei dati ottenuti
con il candesartan e con il valsartan.
Sulla base di questi dati, le linee guida raccomandano l’uso
degli ARBs non solo nei pazienti ACE intolleranti, ma anche
in combinazione con gli ACE-inibitori in pazienti che malgrado
la terapia restano sintomatici, con l’obiettivo della riduzione
della mortalità (classe di raccomandazione IIa, livello
di evidenza B) e delle ospedalizzazioni per SC (classe di raccomandazione
I, livello di evidenza A).
Per quanto riguarda i dosaggi, le linee guida sottolineano come
alti dosaggi di candesartan cilexetil (32 mg/die) o valsartan
(160 mg/bid) siano associati ad un significativo miglioramento
della morbilità e della mortalità cardiovascolare
(CHARM braccio “Added” e “Alternative”)
o della morbilità per SC (Val-Heft), in combinazione
con gli ACE-inibitori.
Il primo studio di associazione di ACE-inibitori e ARBs è
stato lo studio Val-Heft su 5010 pazienti con SC sintomatico
(NYHA II-IV) e ridotta funzione ventricolare sinistra (frazione
di eiezione del ventricolo sinistro - FEVS <40%), randomizzati
ad un trattamento con 160 mg/bid di valsartan o placebo. Il
93% dei pazienti assumeva all’arruolamento ACE-inibitori,
mentre il 35% era in terapia con betabloccanti.
I risultati ottenuti con un dosaggio medio di 254 mg/die hanno
evidenziato come nel gruppo trattato con valsartan il rischio
di endpoint combinato mortalità+morbilità si sia
ridotto significativamente del 13.2% (p=0.009), mentre quello
per ospedalizzazioni del 27.5% (p<0.001). Non è stato
invece dimostrato alcun effetto sulla mortalità.
Lo studio CHARM
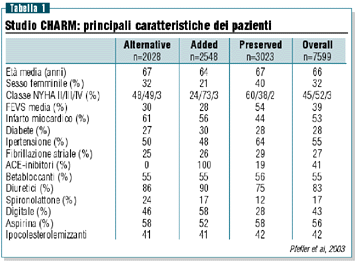 Il
Programma CHARM (Candesartan in Heart Failure-Assessment of
Reduction in Mortality and Morbidity) ha coinvolto 7.601 pazienti
(tabella 1) e rappresenta il più esteso programma di
ricerca condotto nello SC cronico sintomatico con un bloccante
del recettore AT1 dell’angiotensina II. I pazienti affetti
da SC sintomatico con funzione sistolica ventricolare sinistra
depressa (FEVS £40%) sono stati randomizzati al braccio
“Alternative”, se intolleranti all’ACE-inibitore,
o al braccio “Added”, se già in terapia con
ACE-inibitori. I pazienti con funzione sistolica ventricolare
sinistra preservata (FEVS >40%), sono stati invece randomizzati
nel braccio “Preserved”.
Il
Programma CHARM (Candesartan in Heart Failure-Assessment of
Reduction in Mortality and Morbidity) ha coinvolto 7.601 pazienti
(tabella 1) e rappresenta il più esteso programma di
ricerca condotto nello SC cronico sintomatico con un bloccante
del recettore AT1 dell’angiotensina II. I pazienti affetti
da SC sintomatico con funzione sistolica ventricolare sinistra
depressa (FEVS £40%) sono stati randomizzati al braccio
“Alternative”, se intolleranti all’ACE-inibitore,
o al braccio “Added”, se già in terapia con
ACE-inibitori. I pazienti con funzione sistolica ventricolare
sinistra preservata (FEVS >40%), sono stati invece randomizzati
nel braccio “Preserved”.
A tutti i pazienti è stato somministrato candesartan
a dosi crescenti (da 4 a 32 mg/die) o placebo, in aggiunta al
trattamento standard usualmente impiegato per il trattamento
dello SC. La dose di candesartan massima di 32 mg/die è
stata tollerata nel 70% dei pazienti studiati (dosaggio medio
giornaliero 24 mg). Il follow-up medio è stato di 33,
36, 41 mesi nel braccio Alternative, Preserved e Added, rispettivamente.
 La
figura 1 riassume i risultati principali dello studio.
La
figura 1 riassume i risultati principali dello studio.
Il CHARM-Added ha arruolato 2548 pazienti al trattamento con
candesartan o placebo in associazione al trattamento convenzionale
dello SC con ACE-inibitori (100%) e betabloccanti (55%). Nei
pazienti che assumevano una terapia convenzionale per lo SC
con ACE-inibitori (73% in classe NYHA III), il candesartan ha
dimostrato benefici aggiuntivi su mortalità cardiovascolare
(HR 0.84, p=0.029) e ospedalizzazioni per SC (HR 0.83, p=0.014).
Il candesartan ha prodotto una riduzione ulteriore del rischio
di morte cardiovascolare o ospedalizzazione per SC pari al 15%
(p=0.011) rispetto a placebo.
È importante sottolineare che il candesartan ha dimostrato
questa efficacia insieme ad un alto livello di tollerabilità,
anche quando assunto all’interno di una triplice terapia
che includa un ACE-inibitore ed un betabloccante (terapie standard
ormai consolidate nei pazienti affetti da insufficienza cardiaca
cronica).
Al CHARM-Alternative hanno partecipato 2028 pazienti che non
assumevano ACE-inibitori per intolleranza. In questo studio
il candesartan ha ridotto in modo significativo del 23% il rischio
di morte cardiovascolare o ospedalizzazione per SC (p=0.0004).
Questo dato è confrontabile con i vantaggi riscontrati
negli studi sullo SC in cui sono stati impiegati unicamente
gli ACE-inibitori. La tollerabilità è risultata
buona nella maggioranza dei casi, risultato di particolare rilevanza
trattandosi di pazienti già intolleranti agli ACE-inibitori.
Il Programma CHARM ha anche incluso la più grande sperimentazione
clinica mai effettuata su pazienti affetti da SC cronico con
funzione ventricolare sinistra preservata (n=3023), per i quali
attualmente esistono ben poche strategie terapeutiche comprovate.
Nello studio CHARM-Preserved, l’endpoint primario di morte
cardiovascolare o ospedalizzazione per SC ha mostrato un trend
di riduzione dell’11% con il candesartan, in linea con
i positivi risultati visti negli altri due studi CHARM-Alternative
e CHARM-Added. Il numero totale di ospedalizzazioni per SC è
stato significativamente più basso nel gruppo candesartan
(402 contro 566, p=0.014).
È stata anche riscontrata una significativa riduzione
del 40% nel numero di pazienti ai quali è stato diagnosticato
un diabete di nuova insorgenza (47 vs 77, p=0.005).
Anche in questi pazienti la tollerabilità è risultata
molto buona.
L’analisi combinata dei tre studi (n=7601) (CHARM-Overall)
ha mostrato per il candesartan una significativa riduzione dei
decessi cardiovascolari (p=0.006) e ha anche dimostrato un
trend estremamente positivo nella riduzione complessiva della
mortalità per tutte le cause, ai limiti della significatività
statistica (p=0.055). Inoltre, nel gruppo di pazienti in trattamento
con candesartan, il rischio relativo di morte improvvisa si
è ridotto significativamente del 15% rispetto a quanto
osservato nel gruppo di confronto (p=0.036).
La valutazione della classe funzionale NYHA al termine del trial
ha fatto inoltre rilevare un miglioramento significativo nel
gruppo candesartan (35.4%) vs il gruppo placebo (32.5%, p=0.04)
ed una minore insorgenza di casi di fibrillazione atriale (candesartan
6.5% vs placebo 7.9%, p=0.048).
Da sottolineare, infine, una significativa riduzione nell’insorgenza
di nuovi casi di diabete mellito (6% con candesartan rispetto
al 7.4% con placebo; p=0.020).
Considerazioni conclusive
I risultati dello studio CHARM hanno fornito dati di notevole
impatto sulla pratica clinica quotidiana, fornendo motivazioni
convincenti per l’utilizzo del candesartan in un ampio
spettro di pazienti sintomatici per SC malgrado il trattamento
convenzionale. Inoltre i risultati ottenuti nei casi intolleranti
agli ACE-inibitori ci forniscono un’arma efficace in pazienti
altrimenti con ridotte soluzioni terapeutiche. Infine l’efficacia
sulla mortalità cardiovascolare, nei pazienti più
severi, e sui sintomi ed ospedalizzazioni per SC, in tutti i
pazienti indipendentemente dalla funzione del ventricolo sinistro,
appare la più convincente tra quelle dimostrate dagli
ARBs e giustifica la formalizzazione delle indicazioni all’utilizzo
del candesartan nel paziente con scompenso cardiaco.
Bibliografia
• Cohn JN, Tognoni G. N Engl J Med 2001; 345: 1667-75.
• Demers C, et al. JAMA 2005; 294: 1794-8.
• Granger CB, et al. Lancet 2003; 362: 772-6.
• McMurray JJ, et al. Lancet 2003; 362: 767-71.
• O’Meara E, et al. Eur Heart J 2004; 25: 1920-6.
• Pfeffer MA, et al. Lancet 2003; 362: 759-66.
• Solomon SD, et al. Circulation 2004; 110: 2180-3.
• Young JB, et al. Circulation 2004; 110: 2618-26.
• Yusuf S, et al. Lancet 2003; 362: 777-81.
• Yusuf S, et al. Circulation 2005; 112: 48-53.