M.D.
numero 14, 20 aprile 2005
Terapia
Eccessiva crescita batterica, IBS e malattia
diverticolare
di Angela Walmar
La crescita incontrollata dei microrganismi residenti nell’intestino,
ritenuta responsabile della sintomatologia clinica, può
essere corretta con un adeguato trattamento antibiotico
L'ecoflora intestinale, composta da batteri
che colonizzano l’intestino a partire dalle prime ore di
vita extra-uterina, rappresenta un ecosistema selezionato dall’evoluzione,
necessario per il mantenimento dello stato di salute. L’organismo
umano ha stabilito uno stato di simbiosi con questi batteri
e la loro presenza costituisce una barriera nei confronti della
crescita eccessiva di specie patogene nel lume intestinale.
Ma questa importante compagine batterica, composta prevalentemente
da lattobacilli, eubatteri e bifidobatteri, è in grado
di esercitare numerose influenze e lo stato di benessere dell’organismo
dipende dalle corrette interazioni che la flora residente intreccia
con esso. Nell’ambito dell’XI Congresso Nazionale
delle Malattie Digestive (AIGO-SIED-SIGE), svoltosi a Genova
dal 12 al 16 marzo 2005, si è svolto un seminario di
approfondimento scientifico dal titolo “Ecosistema intestinale:
oltre la malattia diverticolare”, dedicato proprio ad alcuni
aspetti di questa relazione, o meglio alla perdita di un equilibrio
funzionale che caratterizza una situazione che la cultura anglosassone
indica come SIBO (Small Intestinal Bacterial Overgrowth) e che
le ipotesi più recentemente accreditate considerano come
momento eziopatogenetico chiave per molti disturbi enterici.
Funzioni dell’ecoflora intestinale
In condizioni fisiologiche all’ecoflora intestinale spettano
compiti diversificati e molto importanti. Grazie alla sua presenza
infatti l’organismo può contare su un costante “rifornimento”
di vitamine essenziali. Altre funzioni metaboliche comprendono
l’assorbimento ionico, la deconiugazione degli acidi biliari,
il metabolismo anaerobio delle proteine, la fermentazione di
carboidrati.
Nell’ambito della sintesi di sostanze antimicrobiche i
batteri svolgono un ruolo determinante grazie alla produzione
di acidi grassi organici, di ione ammonio, di perossido di idrogeno,
di batteriocine. Per quanto attiene ai meccanismi difensivi
questi microrganismi sono in grado di esercitare un’interazione
competitiva con potenziali patogeni.
Sono anche in prima linea nell’immunomodulazione: l’ecoflora
intestinale esercita infatti un effetto adiuvante sull’immunità
intestinale e sistemica e favorisce il mantenimento di una situazione
di equilibrio nella produzione di citochine pro e antinfiammatorie.
Ha inoltre la capacità di modificare eventuali tossine
e recettori tossinici e infine manifesta una evidente capacità
di interazione con la motilità intestinale.
Quest’ultimo aspetto assume un carattere di reciprocità,
nel senso che la microflora interviene sulla motilità
intestinale ma anche che le alterazioni della motilità
intestinale possono determinare delle modificazioni della flora
batterica, che coinvolgono tanto l’aspetto qualitativo
quanto quello quantitativo.
Le condizioni da cui può derivare una modificazione della
flora intestinale comprendono cause modificabili e immodificabili:
alterazioni anatomiche, alterazioni a seguito di interventi
chirurgici. Per i legami tra motilità ed ecoflora è
dimostrato che quest’ultima subisce alterazioni importanti
in caso di sclerosi sistemica progressiva, di neuropatia diabetica,
di pseudo-ostruzione intestinale, di accelerato svuotamento
gastrico, di incontinenza della valvola ileo-cecale.
Infine, alterazioni dell’ecoflora accompagnano malnutrizione,
deficit immunitari ad eziologia varia, età avanzata,
prolungate terapie con alcune classi di farmaci (anti-H2 e inibitori
della pompa protonica).
Conseguenze di una eccessiva crescita batterica
Recentemente l’interesse e l’attenzione degli esperti
del settore si sono concentrate sulla SIBO e sulle correlazioni
tra questa condizione e la sintomatologia clinica di patologie
enteriche. Di particolare rilievo sarebbe il legame tra overgrowth
batterico, malattia diverticolare sintomatica non complicata
e sindrome dell’intestino irritabile (IBS), condizione
nella quale oltre il 90% dei pazienti lamenta gonfiore e dolore,
associati ad alterazioni dell’alvo (stipsi o diarrea).
Sebbene molti pazienti accusino un evidente peggioramento della
sintomatologia dopo l’assunzione di cibo, nella maggior
parte dei casi la ricerca di un possibile alimento “trigger”
ha dato esito negativo. Il che fa supporre, in assenza di una
responsabilità accertata del cibo, che la causa di ciò
sia da imputare a una eccessiva presenza batterica che, agendo
su substrati fermentabili, produce quantità abnormi di
gas.
Nell’intestino normale la presenza di batteri è
concentrata soprattutto nel colon mentre in caso di eccessiva
crescita questi si riscontrano in concentrazioni significative
anche nei tratti più prossimali dell’intestino (da
103 della normalità a 1011).
La validazione di questa teoria risiederebbe nei risultati di
quegli studi che hanno valutato gli effetti di una terapia antibiotica,
a seguito della quale i pazienti con sindrome dell’intestino
irritabile hanno fatto registrare la normalizzazione dell’H2
breath test, un risultato giudicato coerente con l’eradicazione
batterica determinata dal trattamento (Lin HC, JAMA 2004; 292:
852-58).
Benefici della eradicazione batterica
 I pazienti nei quali è stata dimostrata la presenza di
SIBO spesso necessitano di trattamenti a lungo termine e/o ripetuti
nel tempo con antibiotici e, per tale motivo, la scelta deve
orientarsi alle molecole con profilo di tollerabilità
elevata e con bassi tassi di assorbimento sistemico.
I pazienti nei quali è stata dimostrata la presenza di
SIBO spesso necessitano di trattamenti a lungo termine e/o ripetuti
nel tempo con antibiotici e, per tale motivo, la scelta deve
orientarsi alle molecole con profilo di tollerabilità
elevata e con bassi tassi di assorbimento sistemico.
Molti studi sperimentali hanno confermato che, tra gli antibiotici
non assorbibili a disposizione del medico, rifaximina è
in grado di limitare la proliferazione batterica intestinale
sia aerobica sia anaerobica.
Due lavori presentati al congresso di Genova hanno valutato
l’impiego di questo antibiotico in pazienti con overgrowth
batterico. Nucera et al hanno selezionato, da una popolazione
di soggetti con sindrome da intestino irritabile (diagnosticata
secondo i criteri Roma II), 90 pazienti con SIBO, confermata
all’H2 breath test da un picco di H2 >10 ppm dopo ingestione
di 75 g di glucosio. Per valutare l’efficacia e la tollerabilità
di rifaximina i pazienti sono stati assegnati a trattamento
per 7 giorni con posologie crescenti di antibiotico: 600 mg/die
(gruppo A), 800 mg/die (gruppo B), 1200 mg/die (gruppo C). A
distanza di un mese dal termine del trattamento tutti i pazienti
sono stati sottoposti all’H2 breath test, che si è
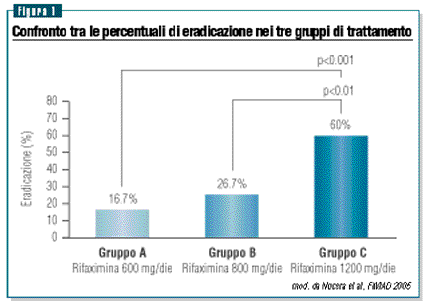
normalizzato nel 16.7% nel gruppo A, nel 26.7% nel gruppo B
e nel 60% nel gruppo C (figura 1).
 Gli
effetti collaterali, risultati praticamente nulli, erano sovrapponibili
nei tre gruppi.
Gli
effetti collaterali, risultati praticamente nulli, erano sovrapponibili
nei tre gruppi.
In un altro studio, Lauritano et al hanno confrontato la capacità
di eradicazione batterica di diversi schemi terapeutici.
Sono stati arruolati 80 pazienti che presentavano contemporaneamente
una sindrome da intestino irritabile e SIBO e quindi suddivisi
in 4 gruppi di trattamento: rifaximina 1200 g/die (gruppo 1),
metronidazolo 750 mg/die (gruppo 2), levofloxacina 500 mg/die
(gruppo 3) e levofloxacina 500 mg/die più metronidazolo
750 mg/die (gruppo 4).
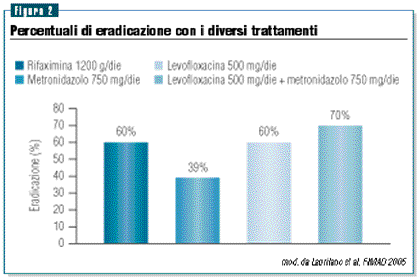
La normalizzazione dell’H2 breath test (eseguito 1 mese
dopo il termine della terapia) è stata registrata nel
60% del gruppo 1 e 3, nel 39% del gruppo 2 e 70% nel gruppo
4 (figura 2). L’elevato tasso di eradicazione di rifaximina
ne fa una scelta opportuna in molte condizioni, anche per l’alto
profilo di sicurezza dovuto all’assorbimento sistemico
pressoché nullo (0.4%).